作者
林偲思,郭主声,钟沛玲,陈桂铃,谢树金,张莉,冯剑波,黄亚,骆海珊,曾丽萍 (中山大学附属东华医院检验科,广东东莞 523110) 来源海南医学2018年12月第29卷第23期 3286-3288 摘要
目的 分析东莞东华医院近三年热带念珠菌的临床分布及耐药情况,为临床防控该类菌奠定基础。 方法 收集中山大学附属东华医院2015-2017年热带念珠菌,采用科玛嘉显色培养基和VITEK-2-COMPACT全自动微生物分析仪鉴定筛选热带念珠菌,用ATB FUNGUS3药敏试剂条(MIC法)和纸片扩散法(K-B法)进行药敏试验,分析其临床分布特点和耐药性。比较两种方法测试热带念珠菌对同种抗菌药物的敏感性有无差异,并对相同药物的药敏结果进行统计学分析。 结果 三年间共分离获得174株热带念珠菌,样本主要来源于ICU、神经外科和普外科,样本种类主要是尿液和分泌物。ATB FUNGUS3药敏试剂条中,对氟康唑、两性霉素B、伏立康唑、伊曲康唑、5-氟胞嘧啶的耐药率为16.1%、0、13.8%、12.6%、0,纸片扩散法中,氟康唑、两性霉素B、伏立康唑、伊曲康唑、酮康唑、制霉菌素的耐药率为13.8%、0、6.9%、4.6%、2.3%、0;两种方法测试热带念珠菌对两性霉素B、氟康唑和伏立康唑的敏感性比较,差异均无统计学意义(P>0.05),但对伊曲康唑的敏感性比较差异有统计学意义(P<0.05)。 结论 K-B法的耐药率普遍低于MIC法,唑类药物的耐药现象比两性霉素B、5-氟胞嘧啶、制霉菌素严重,合理使用抗菌药物,减少二重感染和多重耐药的发生。
关键词
热带念珠菌;临床分布;药敏试验 中国分类号
R379.4 文献标识码A 文章编号1003—6350(2018)23—3286—03 doi
10.3969/j.issn.1003-6350.2018.23.010
由于激素、广谱抗生索、免疫抑制剂等的广泛应用以及各种侵入性操作,导致机体菌群失调和免疫力降低,使热带念珠菌的感染日益增多,耐药现象也日趋加重[1]。本研究通过对东莞东华医院3年来分离到的热带念珠菌临床分布特点及其耐药情况进行分析,以期监测其临床分布及其耐药情况,为防控该类菌的感染及流行提供参考,也为临床经验性用药提供数据支持。
1. 资料与方法
1.1标本来源 2015年1月至2017年11月从东莞东华医院各临床科室送检标本中共分离174株热带念珠菌,标本来源包括尿液、分泌物、血液、穿刺液、引流液和大便等。转种、分离和分纯均严格按照《全国临床检验操作规程》第 4 版[2]的要求进行。同一患者多次分离到的重复菌株不计入。标准菌株为热带念珠菌ATCC 6528。
1.2 仪器与试剂
沙保弱培养基和科玛嘉念珠菌显色培养基来自江门凯林试剂公司;纸片及药敏琼脂由丹麦ROSCO公司提供;ATB FUNGUS3药敏试剂条和VITEK-2-COMPACT全自动微生物分析仪均为法国微生物梅里埃公司产品。
1.3 药敏试验
K-B 法药物选择氟康唑(FLU,25µg)、两性霉素B(AMB,10µg)、伏立康唑(VOR.1,1 µg)、伊曲康唑(ITR,10µg)、酮康唑(KET,15µg)、制霉菌素(NYS,15µg) 6 种抗真菌药;MIC 法采用 ATBFUNGUS3药敏试剂条,对FLU、AMB、VOR.1、ITR、5-氟胞嘧啶(5-FC) 5种抗真菌药物进行耐药分析。
1.4 药敏敏感性判断标准
K-B 法测定抗菌药物的抑菌圈直径,结果判读依据 ROSCO 公司提供判断标准判读。测量抑菌环直径,FLU≤14 mm、AMB≤10 mm、VOR.1≤13 mm、ITTR≤13 mm、KET≤21 mm、NYS≤13 mm判为耐药。MIC法CLSI/NCCLS推荐的念珠菌属分界点见表1。
1.5 统计学方法
应用 WHONET5.6 和 SPSS22.0 统计软件提取数据进行统计分析,计算其敏感率和耐药率等指标,对两组不同方法得出的真菌药敏数据采用配对χ2 Kappa一致性检验,以P<0.05为差异有统计学意义。2. 结 果
2.1 科室分布
分离所得的 174 株热带念珠菌来自ICU 60株、神经外科20株、普外12株、泌尿外科8株、肿瘤内科8株、神经内科6株、产前6株、骨科6株、呼吸内科6株、内分泌科6株、血液科6株、新生儿科6株、肾病科6株以及其他18株,见表2。
2.2 标本类型
样本类型包括尿液 74 株、分泌物40株、肺泡灌洗液18株、血液14株、引流液(盆腔、腹腔) 12株、穿刺液(脑脊液、胸腹水、胆汁) 10株、静脉导管4株、大便2株,见表3。

2.3 K-B 法和 MIC 法对热带念珠菌的药敏性比较 通过对热带念珠菌的 K-B 法和 MIC 法药敏进行分析,结果如表4所示。K-B法中,热带念珠菌对氟康唑、两性霉素B、伏立康唑、伊曲康唑、酮康唑、制霉菌素的耐药率分别为13.8%、0、6.9%、4.6%、2.3%、0;MIC法中,热带念珠菌对氟康唑、两性霉素B、伏立康唑、伊曲康唑、5-氟胞嘧啶的耐药率分别为16.1%、0、13.8%、12.6%、0。检测结果显示,两种方法中的两性霉素B的耐药率均为0,MIC法中的氟康唑、伏立康唑、伊曲康唑的耐药率均普遍高于K-B法。
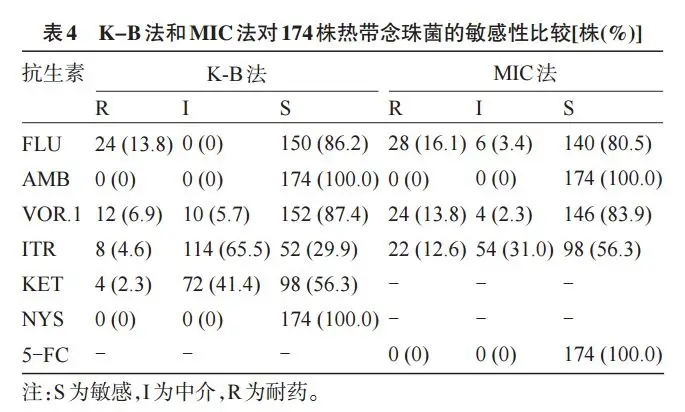
2.4 K-B 法和 MIC 法对同种药物作用热带念珠菌的敏感性比较
K-B 法和 MIC 法测试热带念珠菌对氟康唑和伏立康唑的敏感性比较,差异均无统计学意义(P>0.05),但对伊曲康唑的敏感性比较差异有统计学意义(P<0.05)。K-B法和MIC法对3种抗菌药物的药敏结果比较见表5。
3. 讨 论
热带念珠菌为条件致病菌,存在于健康人体的皮肤、阴道、口腔和消化道等部位,在机体的免疫力低下时可致病。本院近三年临床分离出的174株热带念珠菌的科室分布主要是ICU、外科(普外、神经外科和泌尿外科)、肿瘤内科;标本类型主要为尿液、分泌物、肺泡灌洗液和血液。其中,ICU的患者大多因为呼吸高防御屏障的受损、接受导尿和留置尿管等原因为热带念珠菌提供入侵机体的条件。有研究显示,尿管的插入时间越长,感染热带念珠菌的可能性越高,两者具有高度相关性;外科患者由于各种手术等侵入性操作而感染热带念珠菌;肿瘤内科患者由于免疫力低下,加上化疗而导致的粒细胞减少,也易感染热带念珠菌[3-5]。
本研究药敏结果显示,两性霉素B、5-氟胞嘧啶、制霉菌素对念珠菌有极好的抗菌活性,抑菌率为100.0%,而氟康唑、伏立康唑、伊曲康唑、酮康唑的抗菌活性相比较差。除两性霉素B外,K-B法和MIC法两种方法使用的共同抗菌药物中,氟康唑的耐药率相近,分别为13.8%和16.1%;伏立康唑和伊曲康唑的耐药率相差较大,伏立康唑的耐药率分别为 6.9%和13.8%,伊曲康唑分别为4.6%和12.6%,K-B法的耐药率皆比MIC法要低,这可能是因为体外药敏试验中念珠菌对 ITR的判断是参照黏膜感染的标准制定的,而亲脂性很强的 ITR 在多种组织中的浓度超过血液药物浓度,且 ITR在体内的代谢产物羟基伊曲康唑同样能抑制念珠菌[6-9]。因此临床使用的ITR对不同感染部位的抗真菌疗效可能会不同。当然,造成这样结果的原因也可能因为样本容量不够大造成的抽样误差和MIC法的结果判定出现人为因素的误差;因为MIC法采用ATB FUNGUS3药敏试剂条,结果判定的原则是把试剂条放在黑暗背景下,对于每一个抗真菌制剂,从低浓度开始,与生长对照杯装凹计较,真菌的生长情况大于生长对照孔真菌的20%,视为耐药。对于氟康唑、伏立康唑和伊曲康唑,鉴于可能存在拖尾现象,这对结果的判定造成极大的干扰。 从本研究结果来看,K-B法和MIC法测试热带念珠菌对氟康唑和伏立康唑的敏感性比较,差异均无统计学意义(P>0.05),但对伊曲康唑的敏感性比较差异有统计学意义(P<0.05)。使用K-B法和MIC法会出现药敏结果有差异现象。据相关文献报道,丹麦Rosco的NeoSensitab抗真菌药敏试验能检测真菌对多烯、唑类等15种制剂的敏感度,且操作简便,在欧洲各国广泛应用[9]。国外早有报道其与美国临床实验室标准化委员会的微量稀释法的对FCA药敏结果的契合率高达 87.3%[9]。本研究数据显示,除了 ITR,这两种真菌药敏方法的结果一致性较高,但Rosco纸片在临床上的应用价值还需进一步研究探讨。因此在临床的治疗上应该结合手法和方案去选择抗菌药物的治疗[10]。 热带念珠菌容易感染恶性肿瘤及中性粒细胞缺乏等机体免疫力低下的患者,而且死亡率高于其他念珠菌感染,需要对感染患者进行早期的快速诊断,并且以实验室的检测结果指导临床进行正确的抗真菌治疗。此外,因为热带念珠菌具有更容易形成生物膜等特点,可能会导致院内散播,因此使用分子生物学手段对菌株进行同源性分析,确证是否出现同一克隆菌株的院内传播对医院感染控制及临床医护都具有非常重要的意义[11-12]。
 [参考文献] [1] 刘亚新, 王亚琴, 魏琴. 重症监护病房获得性念珠菌感染的临床分布及耐药分析[J]. 中华医院感染学杂志, 2005, 15(12): 1417-1419. [2] 尚红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 4 版. 北京: 人民卫生出版社, 2015: 781-811. [3] 徐修礼, 杨佩红, 孙怡群, 等. 深部真菌感染的菌群分布及耐药性[J]. 中华医院感染学志, 2007, 17(3): 349-351. [4] 翟红岩, 白玉红, 郭闻涛, 等. 220例痰假丝酵母菌属培养阳性患者抗真菌治疗分析[J]. 中华医院感染学杂志, 2012, 22(6): 1303-1305. [5] 王贺. 中国多中心侵袭性酵母菌感染临床相关科学研究方法体系的探索和建立[D]. 北京: 中国医学科学院北京协和医学院, 2017. [6] Pfaller MA, Messer SA, Jones RN, et al. Antifungal susceptibilities of Candida, Cryptococcus neoformans and Aspergillus fumigatus from the Asia and Western Pacific region: data from the SENTRY antifungal surveillance program (2010-2012) [J]. J Antibiot (Tokyo), 2015,68(9): 556-561. [7] 范欣. 中国多中心连续五年侵袭性感染热带念珠菌流行病学及唑类耐药机制研究[D]. 北京: 中国医学科学院北京协和医学院,2017. [8] 熊志刚, 曹文, 陈中举, 等. 深部酵母菌感染分布及耐药性分析[J].检验医学与临床, 2017, 14(9): 1218-1219, 1223. [9] Vandenbossche I, Vaneechoutte M, Vandevenne M, et al. Susceptibility testing of flucona zole by the NCCLS broth macrodilution method, E-test, and disk diffusion for application in the routine laboratory [J].Journal of Clinical Microbiology, 2002, 40(3): 918-921. [10] 胥振国, 蔡玉华, 袁星, 等. 209株真菌感染分布及耐药分析[J]. 蚌埠医学院学报, 2011, 36(9): 1004-1006. [11] 范欣, 徐英春. 侵袭性热带念珠菌感染流行病学及药物敏感性[J].中国真菌学杂志, 2014, 9(6): 368-372. [12] Chai LY, Denning DW, Warn P. Candida tropicalis in human disease[J]. Crit Rev Microbiol, 2010, 36(4): 282-298.
|