|
医生专读|急性白血病化疗后继发肺部真菌感染一例 作者王 静 卢晓倩 曹殿波 来源中华肺部疾病杂志(电子版) 2019年06月 第12卷第3期 387-389 关键词真菌感染,肺部; 白血病; 化疗; 多脏器 中图法分类号R733.71; R519 文献标识码B DOI10.3877 /cma.j.issn.1674-6902.2019.03.032
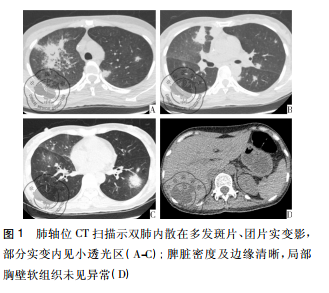
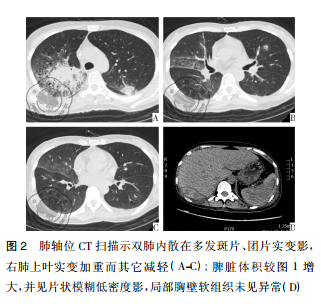
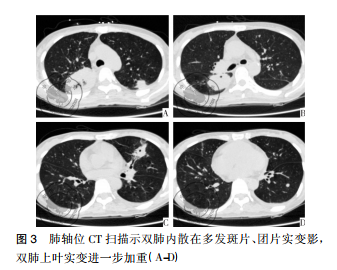
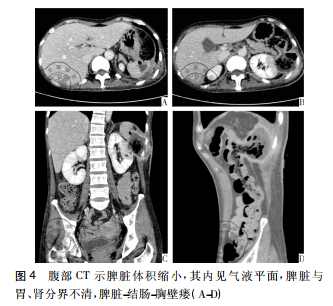
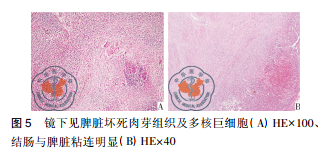
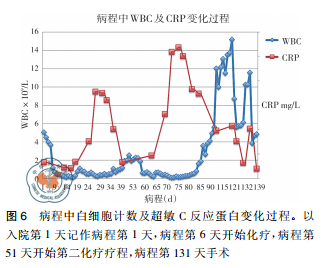
病例资料患者女性,42岁,因“咽痛、牙龈肿痛、发热20余天”于2017年5月13日入院。既往否认肝炎、结核及手术史。查体: 体温 37.8 ℃,贫血貌,齿龈增生,头颈部浅表淋巴结可触及肿大。咽部略充血、红肿,双肺、心脏、腹部查体未见异常。血常规: WBC 4.5×109 /L,RBC 2.23× 109 /L,PLT 67× 109/L,Hb 78 g /L,中性粒细胞绝对值( NE#) 0.22×109 /L。入院后给予抗炎治疗,体温降至正常。经骨髓活检确诊为急性髓系白血病 AML-M5( 中危组) ,于2017 年5月16日起行( 去甲氧柔红霉素+阿糖胞苷) 方案化疗。化疗间歇第14天,骨髓象未缓解,患者出现间断发热,炎性指标超敏C反应蛋白升高,肺CT提示肺内感染、脾脏未见异常,见图 1。故采用伏立康唑加亚胺培南联合抗炎治疗。化疗间歇第21天,骨髓象部分缓解。2017 年 6 月 26 日起给予方案强化巩固治疗。第二化疗间歇第8天,患者出现发热,体温达 39 ℃,伴寒战、大汗,超敏C反应蛋白 47.20 mg /L,降钙素原 19.81 ng /ml,痰培养见肺炎克雷伯菌肺炎亚种,复查肺CT提示肺内感染加重。先后给予美洛培南、阿米卡星、伏立康唑、替考拉宁、泊沙康唑、万古霉素及左氧氟沙星抗感染治疗。第二化疗间歇第16天,患者出现左季肋部疼痛,腹部彩超未见明确异常。腹部CT显示脾实质不均匀低密度伴周围渗出,见图 2。给予抗炎及对症治疗,患者仍间断发热及左季肋部疼痛。第二化疗间歇第 57 天,患者左侧肋下局部软组织隆起,皮肤变红及皮温升高,1周后左侧肋下包块破溃,流黄白色脓液及偶伴臭味,脓汁真菌涂片查到真菌孢子。胸腹部 CT提示肺内真菌感染,见图 3; 脾实质内液气混杂密度影,蔓延至左侧胸腹壁,累及结肠脾曲、左肾实质,伴左侧第10-11肋骨骨质破坏,见图4。遂于2017年9月18日全麻下行剖腹探查术,术中见腹腔大量脓液及粪便,胃、脾表面被覆脓苔,脾脏体积小,脾脏结肠瘘。遂行脾切除术、左侧腹壁窦道切除、结肠脾曲部分切除、肠吻合术及回肠造瘘术,并行胃部分切除术。术后病理示脾坏死、结肠穿孔,坏死周围及穿孔区周围、胃壁浆膜及肌层见大量急慢性炎细胞浸润、脓肿形成、肉芽组织及纤维增生,伴多核巨细胞反应及坏死样物,见图 5。患者病程中白细胞计数及超敏C反应蛋白变化过程如图 6 所示。术后患者恢复较好,进食、排气排便正常,于9月27日顺利出院。
 [参考文献] 【1】 Zhang R,Chen J,Huang H,et al. Primary fungal prophylaxis in acute leukemia patients with different risk factors: retrospective analysis from the CAESAR study[J]. Int J Hematol,2017,106( 2) : 221-228.
【2】 Petrausch U,Frauenfelder T,Mueller NJ,et al. Optimised radiological diagnosis of hepatic fungal infection during the treatment of leukemia[J]. Mycoses,2012,55( 5) : 447-453. 【3】 Migita M,Kaizu K,Asai M,et al. Multiple fungal splenic abscesses in a patient with T-acute lymphoblastic leukemia undergoing chemotherapy[J]. Pediatr Int,2004,46( 6) : 733-735. 【4】 Patiroglu T,Unal E,Karakukcu M,et al. Multiple fungal brain abscesses in a child with acute lymphoblastic leukemia [J]. Mycopathologia,2012,174( 5-6) : 505-509. 【5】 尹秀云,陈建魁,曾利君,等. 白血病患者化疗后多发性曲霉菌骨髓炎的诊治[J]. 中华医院感染学杂志,2014,24( 6) : 1339-1341. 【6】 Dragonetti G,Criscuolo M,Fianchi L,et al. Invasive aspergillosis in acute myeloid leukemia: Are we making progress in reducing mortality? [J]. Med Mycol,2017,55( 1) : 82-86. 【7】 Hori A,Kami M,Kishi Y,et al. Clinical significance of extrapulmonary involvement of invasive aspergillosis: a retrospective autopsy-based study of 107 patients[J]. J Hosp Infect,2002,50( 3) : 175-182. 【8】 Forghieri F,Rossi G,Potenza L,et al. Splenic hyalohyphomycosis, molecularly and immunologically consistent with invasive aspergillosis,in a patient with acute lymphoblastic leukemia[J].Ame J Hematol,2010,85( 3) : 188-189. 【9】 De Pauw B,Walsh TJ,Donnelly JP,et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group ( EORTC/MSG) Consensus Group[J]. Clin Infect Dis,2008,46( 12) : 1813-1821. 【10】 Maccioni F,Vetere S,De Felice C,et al. Pulmonary fungal infections in patients with acute myeloid leukaemia: is it the time to revise the radiological diagnostic criteria? [J]. Mycoses,2016,59( 6) : 357-364. 【11】Picardi M,Della Pepa R,Giordano C,et al. ( 1-3) -beta-D-Glucan serum increase and small-airway-invasive radiological findings as early signs of pulmonary aspergillosis in high-risk hematologic patients in the posaconazole era: preliminary observations[J]. Ann Hematol,2019,98( 2) : 527-531. 【12】 Girmenia C,Guerrisi P,Frustaci AM,et al. New category of probable invasive pulmonary aspergillosis in haematological patients [J]. Clin Microbiol Infect,2012,18( 10) : 990-996. 【13】 Vallipuram J,Dhalla S,Bell CM,et al. Chest CT scans are frequently abnormal in asymptomatic patients with newly diagnosed acute myeloid leukemia[J]. Leuk Lymphoma,2017,58( 4) : 834-841. 【14】 Nucci M,Anaissie E. How we treat invasive fungal diseases in patients with acute leukemia: the importance of an individualized approach[J]. Blood,2014,124( 26) : 3858-3869. 【15】 任成山,郭乔楠. 进一步提高对下呼吸道念珠菌感染的认识[J/CD]. 中华肺部疾病杂志( 电子版) ,2016,9( 5) : 471-478.
( 收稿日期: 2019-01-18) 王 静,卢晓倩,曹殿波. 急性白血病化疗后继发肺部真菌感染一例[J/CD]. 中华肺部疾病杂志( 电子版) ,2019,12( 3) : 387-389. 作者单位: 130021 长春,吉林大学第一医院放射线科
|